Trijodoacetata acido
Ŝablono:Unua Ŝablono:Tabela informkesto
| Trijodoacetata acido | |

| |
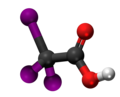
| Kemia strukturo de la Trijodoacetata acido | |

| |
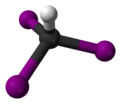
| 3D Kemia strukturo de la Trijodoacetata acido | |
| Alternativa(j) nomo(j) | |
| Trijodoetanoata acido | |
| Kemia formulo | |
| CAS-numero-kodo | 594-68-3 |
| ChemSpider-kodo | |
| PubChem-kodo | 68988 |
| Fizikaj proprecoj | |
| Aspekto | Malhela bruna solido |
| Molmaso | 437,74215 g mol−1 |
| Smiles | OC(=O)C(I)(I)I |
| Denseco | 3,884g/cm−3 |
| Fandopunkto | Ŝablono:GdC - Ŝablono:GdC |
| Bolpunkto | Ŝablono:GdC[1] |
| Ekflama temperaturo | Ŝablono:GdC |
| Refrakta indico | Ŝablono:Refraktindico[2] |
| Sekurecaj Indikoj | |
| Risko | R20 R35 R52/53 |
| Sekureco | S9 S26 S27 S28 S45 S61 |
| Pridanĝeraj indikoj | |
| Danĝero Ŝablono:Danĝerosimboloj | |
| GHS etikedigo de kemiaĵoj | |
| GHS Damaĝo-piktogramo | |
| GHS Signalvorto | Damaĝa substanco |
| GHS Deklaroj pri damaĝoj | Ŝablono:H-Frazoj |
| GHS Deklaroj pri antaŭgardoj | Ŝablono:P-Frazoj |
Trijodoacetata acido, hidrogena trijodoacetato aŭ I3C-COOH estas organika kemiaĵo, derivita el jodigo de acetata acido, toksa kaj koroda kombinaĵo, kie ĉiuj hidrogenatomoj de la metila grupo (-CH3) estis anstataŭataj de jodatomoj.Trijodoacetata acido preparatas ekde malonata acido kaj jodata acido en akva solvaĵo.
Trijodoacetata acido estas malstabila sub alta temperaturo kaj malkomponiĝas en jodo, jodoformo kaj karbona duoksido.[3] Trijodoacetata acido malrapidigas la polaran movadon de la aŭksino en vegetalaj histoj, kaj do ĝi povas akumuliĝi en specifaj lokoj de la plantoj. En certaj kondiĉoj ĝi povas simuli la aŭksinajn aplikojn.[4]
Fluoroacetata, kloroacetata, bromoacetata kaj jodoacetata acidoj estas pli fortaj ol acetata acido.
Reakcioj
Reakcio 1
- Trijodoacetata acido povas rezulti el interagado de acetila klorido kaj jodo, sekvata de hidrolizo:
|
acetila klorido + 3 |
Reakcio 2
- Kiam trijodoacetata acido varmiĝas kun acetata acido aŭ kiam ĝi estas traktata kun alkalaj karbonaotoj, ĝi disrompiĝas en jodoformon kaj karbonan duoksidon:
|
|
Reakcio 3
- Produktado per interagado de la malonata acido kun jodata acido:
|
2 |
Proprecoj
Trijodoacetata acido kaj tribromoacetata acido prepareblas per halogenigo de malonata acido kun jodo aŭ bromo en acida akva solvaĵo laŭ la metodo de Scheme. Trijodoacetata acido estas kristala kombinaĵo kaj rapide malkomponiĝas kiam hejtata.[5] La dekstrotiroksino, same kiel ĝiaj derivaĵoj el acetata acido, ekzemple de trijodoacetata acido, pro ĝia malpli potencaj efektoj sur la metabolo, ofte uzatas kiel farmakologiaj agentoj por malaltigo de kolesterolo.[6] Laŭ kelkaj studoj, la tiroksino kaj la trijodoacetata acido plialtigas la asimiliĝon de la glukozo.[7]
Literaturo
- SCBT Ŝablono:Webarchiv
- Chemical Book
- Chemnet Ŝablono:Webarchiv
- 3B Scientific CorporationŜablono:404
- Medical Isotopes Ŝablono:Webarchiv
- Molbase
Referencoj
Halogenidaj derivaĵoj de acetata acido
-
Trijodoacetata acido
Ŝablono:Portalo Ŝablono:Projektoj Ŝablono:Ĝermo
- ↑ ChemSRC
- ↑ ChemNET
- ↑ Acetic Acid and its Derivatives, Victor H. Agreda
- ↑ Pollination Mechanisms, Reproduction and Plant Breeding, R. Frankel, Esra Galun
- ↑ Science of Synthesis: Houben-Weyl Methods of Molecular Transformations, Volume 22
- ↑ Principles of Endocrine Pharmacology, John A. Thomas, Edward J. Keenan
- ↑ Handbook on Plant and Cell Tissue Culture, NIIR Board of Consultants and Engineers