Kalia hipoklorito
Ŝablono:Vidu ankaŭ Ŝablono:Tabela informkesto
| Kalia hipoklorito | |
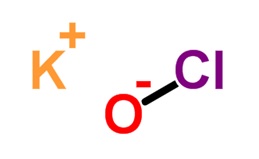 | |
| Plata kemia strukturo de la Kalia hipoklorito | |
| Tridimensia kemia strukturo de la Kalia hipoklorito | |
| Alternativa(j) nomo(j) | |
| |
| Kemia formulo | |
| CAS-numero-kodo | 7778-66-7 |
| ChemSpider kodo | 56409 |
| PubChem-kodo | 23665762 |
| Merck Index | 15,4904 |
| Fizikaj proprecoj | |
| Aspekto | senkolora likvaĵo |
| Molmaso | 90.547 g·mol−1 |
| Denseco | 1.160g cm−3 |
| Fandpunkto | Ŝablono:GdC |
| Bolpunkto | Ŝablono:GdC |
| Acideco (pKa) | 7.4 |
| Solvebleco | Akvo:Tute solvebla |
| Mortiga dozo (LD50) | 192 mg/kg (buŝe) |
| GHS etikedigo de kemiaĵoj | |
| GHS Damaĝo-piktogramo | |
| GHS Signalvorto | Damaĝo |
| GHS Deklaroj pri damaĝoj | Ŝablono:H-Frazoj |
| GHS Deklaroj pri antaŭgardoj | Ŝablono:P-Frazoj |
(Ŝablono:GdC kaj 100 kPa) | |
Kalia hipoklorito estas kalia salo de hipoklorita acido, senkolora likvaĵo kun forta odoro, forta oksidiganto kun blankigaj proprecoj, uzata en hejma purigado kaj en kemiaj sintezoj. Ĝenerale ĝi komerceblas en 35% solvaĵo kaj uzatas kiel seninfektilo kaj sanigo de la trinkavoj.
En 1789, Claude Louis Berthollet (1748-1822) unue sintezis ĝin kaj nomis ĝin Akvo de Ĵavelo, administra distrikto de Parizo. Ĉar kalia hipoklorito en akva solvaĵo estigas hipokloritan acidon, ĝi uzatas kiel baktericido kaj fungicido. Tia kia natria hipoklorito, kalia hipoklorito estas irita substanco kaj povas kaŭzi damaĝojn ĉe kontakto kun haŭto, okuloj kaj mukoza membranoj.
Inhalado de kalia hipoklorito kaŭzas bronkan iriton, spirmalfacilecon kaj en pli seriozaj kondiĉoj pulmedemon. Ingestado de fortaj koncentriĝoj de kalia hipoklorito estas mortigaj. Solvaĵoj de kalia hipoklorito povas eksplode reakcii kun sennombraj kemiaĵoj, tiaj kiaj ureo, amoniakaj saloj, metanolo, acetileno kaj multaj organikaj komponaĵoj. Varmigo kaj acidido de ĝiaj solvaĵoj povas estigi toksajn gasojn.
Sintezo
- Kalia hipoklorito estas preparata per agado de kloro sur kalia hidroksido:
Literaturo
- Chemical Book
- Handbook of Detergents, Part F: Production, Uri Zoller,Paul Sosis
- Disinfection, Sterilization, and Preservation, Seymour Stanton Block
- Disinfection by Sodium Hypochlorite: Dialysis Applications, Claudio Ronco, Gary J. Mishkin
- Bleaching: Being a Resumé of the Important Researches on the Industry ..., Sydney Herbert Higgins
- TOXICOLOGY OF THE EYE: Effects on the Eyes and Visual System from ..., Volume 1, W. Morton Grant, Joel S. Schuman
Vidu ankaŭ
- Kalia formiato
- Kalia acetato
- Kalia dehidroacetato
- Kalia acetoacetato
- Hipoklorita acido
- Klorita acido
Ŝablono:Neorganikaj saloj de kalio Ŝablono:Organikaj saloj de kalio