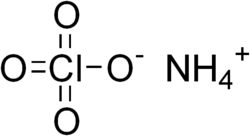Amonia perklorato
Amonia perklorato aŭ NH4ClO4 estas neorganika kombinaĵo, rezultanta el reakcio inter la perklorata acido kaj amoniako. Ĝi estas potenca oksidanto, kaj tio klarigas ĝian ĉefan uzon kiel solida propulsanto. Pluraj akcidentoj jam okazis pro ĝia maladekvata uzo kaj la plej fama estas la katastrofo de PEPCON[1], en la 4-a de majo 1988.
Produktado
Amonia perklorato estiĝas per reakcio inter la amoniako kaj perklorata acido, kaj ĝi estas la ĉefa kialo por industria produktado de perklorata acido. Ĝi same estas produktebla per reakcio inter la amoniaj saloj kun natria perklorato. Ĉi-procezo faras uzon el la solvebleco de la NH4ClO4 kiu estas dekfoje malpli ol tiu de la natria perklorato.
NH4OH + HClO4 → NH4ClO4 + H2O
2 NaClO4 + (NH4)2CO3 → 2 NH4ClO4 + Na2CO3
aŭ
2 NaClO4 + NH4Cl → 2 NH4ClO4 + NaCl
HClO4 + NH4Cl → 2 NH4ClO4 + HCl
Uzoj kaj reakcioj
Amonia perklorato estas la malpli solvebla salo el ĉiuj kombinaĵoj de amonio: ĉirkaŭ 20 gramoj dissolviĝas en 100 ml da akvo. Kiam varmigita supra ol Ŝablono:GdC ĝi malkomponigas kun estigo de klorida acido, oksigeno, nitrogeno kaj akvo.
Amonia perklorato uzatas, kune kun aglutinaĵo, kiel solida raketo-propulsilo; en la fajro-artefaritaĵoj kiel eksplodaĵo. La eksplodaj produktoj rezulte de la malkomponiĝo de la amonia perklorato ekspansiiĝas pro la varmo kreita en la reakcio. La amonia jono agas kiel reduktagento, kaj la perklorata anjono kiel oksidanto. La oksigeno kaj nitrogeno rezultanta povas interreakcii.
Tiamaniere ke, oni povas aldoni 30% da aluminia polvo kiu servas kiel aktiva brulaĵo, kaj pro la alta temperaturo de la reakcio, la interago de la substancoj daŭras. La specifa impulso[2] estas la plej malgranda ol la plejmulto de la likvaj brulaĵoj. La senkontrola brulado de la amonia perklorato estas tre danĝera. Ekzemple, la kemia akcidento en PEOCON, urbo Henderson, Nevado, Usono sentiĝis 45 km-oj malproksima.
Literaturo
- Chemistry of Pyrotechnics: Basic Principles and Theory, Second Edition, John A. Conkling, Chris Mocella
- Chemistry and Chemical Reactivity, Enhanced Edition, John Kotz, Paul Treichel, John Townsend
- Applications of Environmental Aquatic Chemistry: A Practical Guide, Third ..., Eugene R. Weiner
- ADVANCES IN CHEMICAL ENGINEERING, Volume 7
- Perchlorate in the Environment, Edward Todd Urbansky
- Chemistry of High-Energy Materials, Thomas M. Klapötke
- Issues in Chemistry and General Chemical Research: 2011 Edition
Belaj prezentaĵoj de Youtube
- Reakcio inter amonia perklorato kaj aluminio
- Reakcio inter amonia perklorato kaj aluminia polvo
- Eksplodaĵo kun amonia perklorato
- Propulsagento per senfuma amonia perklorato
- Raketa motoro en statika testo kun amonia perklorato
Ŝablono:Neorganikaj saloj de amonio Ŝablono:Organikaj saloj de amonio
Referencoj
Ŝablono:Portalo Ŝablono:Projektoj
- ↑ Sun, Sin & Suburbia: An Essential History of Modern Las Vegas, Geoff Schumacher
- ↑ Specifa impulso estas la periodo en sekundoj, dum kiu 1 kg da maso de propergolo estigos ekpuŝon kun 1 kg da forto (kg/s).