Ŝablono:Tabela informkesto
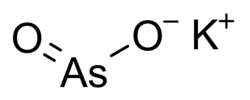
Kalia arsenito aŭ kalia meta-arsenito estas neorganika kombinaĵo konsistanta je unu kaliatomo, unu arsenatomo kaj du oksigenatomoj. Aliaj arsenitoj estas la kalia orto-arsenito (K3AsO3) kaj la kalia piro-arsenito (K4As2O5). En ĉiuj arsenitoj la arsenatomo havas oksidan nombron egala al +3.
Kiel ĉiuj arsenaj derivaĵoj, tiel kalia arsenito estas uzata kiel herbicido, insekticido kaj fungicido. Krom tio, arsenaĵoj estas alte toksaj kaj karcinomogenaj substancoj. Kalia meta-arsenito estas ankaŭ konata kiel solvaĵo de Fowler, ĉar en la 18-a jarcento ĝi estis preskribita kiel kuracilo kaj toniko, kaj ankaŭ en la traktado de leŭkemio.
Ordinare ĝi estas senodora blanka substanco, larĝe akvosolvebla e malmulte solvebla en alkoholo. Ĉar kalia arsenito estas nebrulema, kutime varmigo rezultas en malkomponiĝo k formiĝo de toksaj fumoj inklude de arseno, arsenoksidoj kaj kalioksidoj.
Sintezoj
Sintezo 1
|
|
Sintezo 2
Sintezo 3
|
|
Reakcioj
Reakcio 1
- Kiam varmigita, kalia arsenito malkomponiĝas suferante misproporcion:
|
|
Reakcio 2
- Varma akvo malkomponigas ĝin por estigi kalian duhidrogenan arseniton:
Reakcio 3
- kalia meta-arsenito iom-post-iom oksidiĝas de la atmosfera oksigeno al orto-arsenito:
Reakcio 4
- En alkalaj solvaĵoj la meta-arsenito oksidiĝas al hidrogena arsenato:
|
|
Reakcio 5
- Meta-arsenito reakcias kun diluitaj acidoj:
|
|
Reakcio 6
- La samo okazas kun koncentritaj acidoj:
|
|
Reakcio 7
- kalia meta-arsenito reakcias kun alkaloj por estigi orto-arsenitojn:
Reakcio 8
- Ĝi oksidiĝas en alkala medio:
|
|
Reakcio 9
- kalia meta-arsenito reakcias kun stana (II) klorido kaj klorida acido por estigi arsenon, heksaklorostanato de hidrogeno kaj kalia klorido:
|
|
Reakcio 10
|
|
Reakcio 11
Reakcio 12
|
|
Reakcio 13
|
|
Literaturo
Referencoj
Ŝablono:Referencoj
Ŝablono:Neorganikaj saloj de kalio
Ŝablono:Organikaj saloj de kalio
Ŝablono:Ĝermo