Amonia klorido
| Amonia klorido | |
| Kemia strukturo de la Amonia klorido | |
| Dosiero:Ammonium chloride 3D.png | |
| 3D Kemia strukturo de la Amonia klorido | |
| |
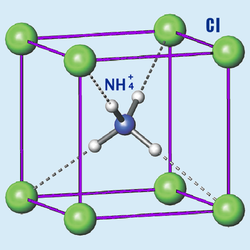
| Kristala strukturo de la amonia klorido | |

| |
| Klorido de amonio en pulvoro. | |
| Alternativa(j) nomo(j) | |
| Salo de amoniako Salo de Armanjako Ammoniæ hydrochloras[1] | |
| Kemia formulo | NH4Cl
|
| CAS-numero-kodo | 12125-02-9 |
| ChemSpider kodo | 23807 |
| Fizikaj proprecoj | |
| Aspekto | Blanka, hidroskopa kaj senodora kristala solido. |
| Molmaso | 53.49 g mol−1 |
| Smiles | [Cl-].[NH4+] |
| Denseco | 1.5274 g/cm3 (likva) |
| Refrakta indico | Ŝablono:Refraktindico |
| Fandopunkto | Ŝablono:GdC (Ŝablono:GdF; 611 K) malkomponiĝas, sublimiĝas |
| Bolpunkto | Ŝablono:GdC (Ŝablono:GdF; 793 K) |
| Solvebleco |
|
| Acideco (pKa) | 9.24 |
| Mortiga dozo (LD50) | 1,650 mg/kg |
| Ekflama temperaturo | Ne bruliva |
| Sekurecaj Indikoj | |
| Risko | |
| Sekureco | |
| Pridanĝeraj indikoj | |
| Danĝero Ŝablono:Danĝerosimboloj | |
| GHS etikedigo de kemiaĵoj | |
| GHS Damaĝo-piktogramo | |
| GHS Signalvorto | Averto |
| GHS Deklaroj pri damaĝoj | Ŝablono:H-Frazoj |
| GHS Deklaroj pri antaŭgardoj | Ŝablono:P-Frazoj[2] |
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo
(Ŝablono:GdC kaj 100 kPa) | |
Amonia klorido aŭ NH4Cl estas neorganika kombinaĵo, blanka kristala salo, alte solvebla en akvo. Solvaĵoj de amonia klorido estas milde acidaj. Amoniaka salo estas la nomo de la natura mineralogia formo de la amonia klorido.
La mineralo ĝenerale formiĝas sur brulantaj karbonrestaĵoj, pro la kondensiĝo de karbonderivitaj gasoj. Ĝi same trovatas ĉirkaŭ kelkaj tipoj da volkanaj aperturoj. Ĝi uzatas kiel gustigilo en kelkaj specioj de Glycyrrhiza glabra kaj estas reakciprodukto inter la klorida acido kaj la amoniako.
Fontoj
Amonia klorido estiĝas pere de la Procezo Solvay uzata por la produktado de la natria karbonato
CO2 + 2 NH3 + 2 NaCl + H2O → 2 NH4Cl + Na2CO3
Krom esti la ĉefa metodo por produktado de amonia klorido, ĉi-metodo uzatas por malpliigo de amoni-eligo en kelkaj industriaj operacioj. Amonia klorido preparatas komerce per kombiniĝo de amoniako kun klorida acido en akva solvaĵo:
NH3 + HCl → NH4Cl
Dosiero:08. Директна синтеза на амониум хлорид.webm La salo puriĝas per kristaliĝo kaj sublimiĝo. Dum purigado, oni miksas ĝin kun 5% "kalcia fosfato" por eviti sublimadon de ajnaj volatilaj fersaloj dum sublimiĝo-procezo. La sublimiĝo okazas en fanditaj ferpotoj protektitaj per argilo fajrorezista kaj kun vitra kupolo.
Amonia klorido okazas nature en volkanaj regionoj, estigita sur volkanaj ŝtonoj apud fumeligaj aperturoj aŭ fumaroloj. La kristaloj sedimentiĝas rekte el la gasa stato, kaj ĝenerale estas mallongedaŭraj pro tio ke ili dissolviĝas facile en akvo.
Amonia klorido produktatas el reakcio inter amoniako, karbonata acido kaj natria klorido, laŭ la ekvacio:
Laboratorie, la amonia klorido estiĝas per reakcio inter la klorida acido kaj amoniako en akva solvaĵo.
Kelkfoje oni povas uzi la reakcion inter la amoniako kun kloro.
Reakcioj
Klorido de amonio sublimiĝas per varmigo. Tamen, ĉi-procezo akompanatas per malkomponiĝo en amoniakon kaj kloridan acidon.
NH4Cl → NH3 + HCl
Simile, amonia klorido same reakcias kun karbonatoj de alkalaj metaloj sub altaj temperaturoj, estigante amoniakon kaj kloridon de la alkala metalo:
NH4Cl + NaOH → NH3 + NaCl + H2O
Amonia klorido reakcias kun forta bazo, ekzemple, natria hidroksido, kaj liberigas amonian gason:
2 NH4Cl + Na2CO3 → 2 NaCl + CO2 + H2O + 2 NH3
Akva solvaĵo 5% de amonia klorido havas pH inter 4,6 kaj 6,0. Kelkaj el la reakcioj de la amonia klorido kun aliaj kemiaĵoj estas endotermaj[3], ekzemple, ĝia reakcio kun "baria hidroksido"[4] kaj ĝia dissolviĝo en akvo.
Uzoj
Medicino
Amonia klorido uzatas kiel elkraĉigilo en kontraŭtusa traktado. Ĝia elkraĉiga agado kaŭzatas de iritiva agado sur la bronko-mukozo. Ĉi-tio kaŭzas produktadon de troa spirosistema fluidaĵo kiu supozeble estas pli facile forigebla. Amoniaj saloj estas iritaj al la gastra mukozo kaj eble induktas al naŭzo kaj vomo.
Amonia klorido uzatas kiel sistemo-acidigagento en la traktado de pluraj seriozaj metabolaj alkalozoj, en testoj por buŝacida enŝarĝo por diagnozo de la dista[5] reno-tuboforma acidozo[6], por konservado de la urino kun acido pH en la traktado de kelkaj malsanoj el la urina sistemo.
Nutraĵo
En pluraj landoj, amonia klorido, konata kiel amoniaka salo, uzatas kiel nutroaldonaĵo sub la E numero 510, kutime kiel nutrofermento por panfarado. Ĝi uzatas kiel nutrosuplemento por la brutaro kaj ingredienco en nutroindustrio por fermentoj kaj pluraj mikroorganismoj.
Amonia klorido uzatas kiel spico kelkaj dolĉaĵojn tre popularajn en Skandinavio, ĉefe en Finnlando; en panejoj por doni al la biskvitoj ian krispan konsistaĵon; kaj kiel gustigilo al la vodko konata kiel "Salmiakki Koskenkorva". En Hindio kaj Pakistano, ĝi nomatas "Noshader" kaj uzatas por plibonigi la krispecon de kelkaj manĝetoj tiel kiel samosoj kaj "ĵalebo"[7].
En laboratorio
Amonia klorido uzatas por produktado de maltaltaj temperaturoj en malvarmigaj banoj. Solvaĵoj de amonia klorido ofte uzatas kiel bufraj solvaĵoj.
En paleontologio, vaporaĵoj da amonia klorido precipitiĝas sur fosilioj, en kiu la substanco iĝas ia inerta tavolo da etegaj kristaloj, brile blankaj, tre facile forigeblaj kaj sendanĝeraj. Ĉi-substanco kovras ajnan koloriĝon kiun la fosilio eble prezentas, kaj kiam lumigita sur certa angulo, alte plibonigas kontraston por fotografiaj dokumentadoj de tri-dimensiaj specimenoj. La sama tekniko aplikiĝas en arkeologio por reflekto-forigo survitre kaj fotografie.
Literaturo
- Handbook of Corrosion Data, Bruce D. Craig, David S. Anderson
- Encyclopedia of Food and Color Additives, Volume 3, George A. Burdock
- Concise Inorganic Pharmaceutical Chemistry (phar.Che-I), Dr. K. R. Mahadik
- Gardner's Commercially Important Chemicals: Synonyms, Trade Names, and ..., G. W. A. Milne
- Comprehensive Qualitative Analysis for Advanced Level Chemistry, E. N. Lambert, M. J. Mohammed
- Chemistry and Physics for Nurse Anesthesia, Second Edition: A Student ..., David Shubert PhD, John Leyba PhD
- Diagnostic Function Tests in Chemical Pathology, P.T. Lascelles, D. Donaldson
- Science for Ninth Class Part2 CHEMISTRY, lakhmir singh and manjit kaur
- Proctor and Hughes' Chemical Hazards of the Workplace, Nick H. Proctor, James P. Hughes, Gloria J. Hathaway
- Chest of Books
- Pharmaceutical Chemistry - I, Dr. A. V. Kasture
Belegaj prezentaĵoj de Youtube
- Apartigo de amonia klorido kaj sablo
- Varmigo de amonia klorido
- Separigo de miksaĵoj pere de sublimiĝo
- Laboratoria produktado de amonia klorido
- Amonia klorido
Referencoj
Ŝablono:Portalo Ŝablono:Projektoj Ŝablono:Neorganikaj saloj de amonio Ŝablono:Organikaj saloj de amonio Ŝablono:Kloridoj
- ↑ British Pharmacopoeia
- ↑ Ŝablono:Citaĵo el la reto
- ↑ Endothermic and Exothermic Reactions
- ↑ Bario: Perioda tabelo per bildoj
- ↑ La vortoj distaj kaj maldistaj, rilate al nomenklaturo de la vertebruloj, rilatas al partoj de la sistemo kiuj estas proksimaj aŭ malproksimaj al la ĉefa korpomaso.
- ↑ Rena tuboforma acidozo estas medicina kondiĉo rezultante en la akumuliĝo de acido en la korpo pro kolapso de la renoj kun samtempa urinacidigo.
- ↑ Ĵalebo estas tre populara manĝaĵo en sudo de Azio, Mezoriento, nordo de Afriko (escepte de Moroko kaj Orientafriko. Ĝi fariĝas per longedaŭra fritado de tritika faruno en brecoj aŭ cirklaj formatoj kiuj tiam estas trempitaj en siropo.