Fluorosulfata acido
| Fluorosulfonata acido | |
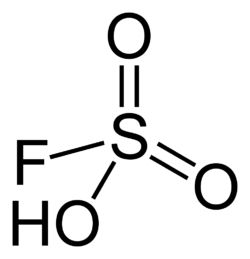
| |
| Kemia strukturo de la Fluorosulfonata acido | |
| 3D Kemia strukturo de la Fluorosulfata acido | |
| Alternativa(j) nomo(j) | |
| |
| Kemia formulo | |
| CAS-numero-kodo | 7789-21-1 |
| ChemSpider kodo | 23005 |
| PubChem-kodo | 24603 |
| Fizikaj proprecoj | |
| Aspekto | Senkolora likvaĵo |
| Smiles |
|
| Denseco |
|
| Fandopunkto | Ŝablono:GdC; Ŝablono:GdF; 185.7 K |
| Bolpunkto | Ŝablono:GdC; Ŝablono:GdF; 438.5 K |
| Acideco (pKa) | -10 |
| Merck Index | 14,2165 |
| Sekurecaj Indikoj | |
| Risko | R5 R8 R20 R35 |
| Sekureco | (S1/2) S26 S45 |
| Pridanĝeraj indikoj | |
| Danĝero Ŝablono:Danĝerosimboloj | |
| GHS etikedigo de kemiaĵoj | |
| GHS Damaĝo-piktogramo | |
| GHS Signalvorto | Damaĝa substanco |
| GHS Deklaroj pri damaĝoj | Ŝablono:H-Frazoj |
| GHS Deklaroj pri antaŭgardoj | Ŝablono:P-Frazoj |
(Ŝablono:GdC kaj 100 kPa) | |
Fluorosulfata acido, fluorosulfonata acido aŭ FSO2OH estas fluora okso-acido, unu el la plej fortaj acidoj komerce disponeblaj, kvaredra molekulo, senkolora likvaĵo, kvankam ĝiaj komercaj specimenoj ofte estas flavaj.
Proprecoj
Fluorosulfata acido estas solvebla en polaraj organikaj solvaĵoj (tiel kiel nitrobenzeno, acetata acido kaj etilacetato), sed malmulte solvebla en nepolaraj solvaĵoj tiel kiel la alkanoj. Rilate al ĝia forta acideco, ĝi dissolvas preskaŭ ĉiujn organikajn komponaĵojn, eĉ tiujn kiuj estas malfortaj protonacekceptantoj. Fluorosulfonata acido hidroliziĝas al fluorida acido kaj sulfata acido. La kunrilata triflata acido konservas la altan acidecon de la fluorosulfonata acido, tamen, ĝi estas pli hidrolize stabila. La memjonizigo de fluorosulfata acido ankaŭ eblas, laŭ la ekvacio:
Super-acidoj
FSO2OH estas unu el la plej fortaj simplaj acidoj konataj kiel acidoj de Brønsted, kvankam la acidoj surbaze de karboranoj estas pli fortaj. La kombinado inter FSO2OH kaj la acido de Lewis antimona kvinfluorido[1] produktas la magian acidon[2], kiu estas la plej forta protonigagento. Ĉi-acidoj apartenas al la kategorio de la superacidoj, kaj estas 100% pli fortaj ol sulfata acido.
Aplikoj
Fluorosulfata acido estas alte toksa kaj koroda substanco. Ĝi uzatas por gravurado de vitraĵoj. Ĝi izomerigas alkanojn kaj alkiligas hidrokarbonidojn en alkenojn, kvankam oni ne povas diri ke tiuj aplikoj estas komerce gravaj. En laboratorio, fluorosulfata acido uzatas kiel fluorigagento. Ĝi reakcias pli eksplode kun akvo ol sulfata acido.
Sintezo
- Fluorosulfata acido prepareblas pere de reakcio inter fluorida acido kaj sulfura trioksido:
- Ankaŭ per interagado de fluorida acido kaj klorosulfata acido:
- Traktado de kalia hidrogena fluorido aŭ kalia bifluorido kaj sulfura trioksido:
Reakcioj
- Fluorosulfonata acido hidroliziĝas al fluorida acido kaj sulfata acido.
- Neŭtraliga reakcio kun natria bikarbonato:
Literaturo
- Sigma Aldrich
- ACS Publications
- Cameo Chemicals
- Science Direct
- Chemical Book
- Acta Crystallographica
- Advances in Inorganic Chemistry and Radiochemistry, Volume 24
- Inorganic Chemistry, Egon Wiberg, Nils Wiberg
- Superacid ChemistryŜablono:404, George A. Olah, G. K. Surya Prakash, Jean Sommer, Arpad Molnar
Referencoj
Ŝablono:Portalo Ŝablono:Projektoj Ŝablono:Ĝermo Ŝablono:Prikemiaj temoj